一次反応においては,
\(\Large \require{AMScd} \begin{CD} A @>{k_B} >> B \end{CD} \)
となります.
速度定数,kB,の次元は,1/s,なので,
1秒間に何回反応が進むか?
となります.従って,1分子において反応が進む時間は,
\(\Large t_{A \rightarrow B} = \frac{1}{k_B} \)
となります.
モンテカルロシュミレーションにて確認してみましょう.
ある時間,dt,の間に反応が進む割合は,
\(\Large P(dt) = k_B \times dt \)
となるので,0~1がでる乱数を与えて,P(dt)の場合に反応が進むとすればいいわけです.
解析的なとき方は,ここ,をご覧ください.

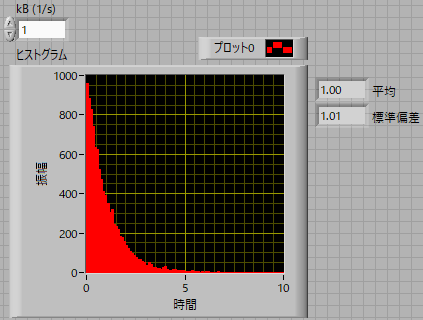
結果はこの通り,
kB = 1 (1/s)
のとき,指数関数分布となり,平均は1秒となります.
次に,逐次反応について考えていきましょう.